ИНСТИТУТ ЦИТОЛОГИИ РОССИЙСКОЙ АКАДЕМИИ НАУК
| Лаборатория цитологии опухолевого роста |
ИВАНОВ Вадим Александровичд.б.н.Тел.: (812) 297-42-34
Лаборатория цитологии опухолевого роста (ЛЦОР) была создана в 1977 г. д.б.н. В.Я. Фелем на базе Лаборатории генетики опухолевых клеток, основанной известным генетиком д.б.н., проф. Ю.М. Оленовым. C 1989 г. ЛЦОР возглавляет д.б.н. В.А. Иванов. |

|
| В лаборатории проводится биохимическое и иммунологическое изучение цитодифференцировки малигнизированных клеток и роли иммунного надзора в обеспечении противоопухолевой защиты организма. Основной объект исследований – экспериментальные злокачественные опухоли, индуцированные у животных химическими канцерогенами. В 1980-90 гг. в лаборатории получены новые приоритетные данные об одном из основных процессов нарушения цитодифференцировки клеток при канцерогенезе – антигенной дивергенции, осуществляемой за счет опухолеассоциированных гетероорганных антигенов. Таким термином предложено обозначать антигены опухолевых клеток, присущие дефинитивным тканям, негомологичным исследуемой опухоли. Показано, что гетероорганные опухолеассоциированные антигены одной тканевой принадлежности могут быть выявлены в различных компартментах клетки – в составе ядерных негистоновых белков хроматина, цитоплазмы и наружных мембран. Особое внимание уделялось изучению ранних сроков канцерогенеза, в частности изменениям антигенного состава тканей-мишеней в 1-е сут после однократного воздействия канцерогенов. Развитие концепции о функционировании в организме системы надзора за состоянием цитодифференцировки послужило импульсом к изучению иммунокомпетентных клеток, осуществляющих этот надзор. В лаборатории был модифицирован и впервые применен метод, позволяющий охарактеризовать уровень активности эффекторных клеток спонтанного иммунитета – естественных киллерных клеток различного происхождения. |

|
Сотрудники лаборатории
с.н.с. к.б.н. Н.П. Терюкова
|
|
В настоящее время исследования проводятся по следующим направлениям:
Исследования проводятся с использованием современных методов экспериментальной онкологии, молекулярной биологии, препаративной и аналитической биохимии, цитологии, иммунологии, масс-спектрометрии, проточной цитометрии и др. Работа лаборатории поддерживается грантами РФФИ. Наиболее важные достижения сотрудников ЛЦОР:
В разные годы осуществлялось сотрудничество с различными научными организациями:
|
|
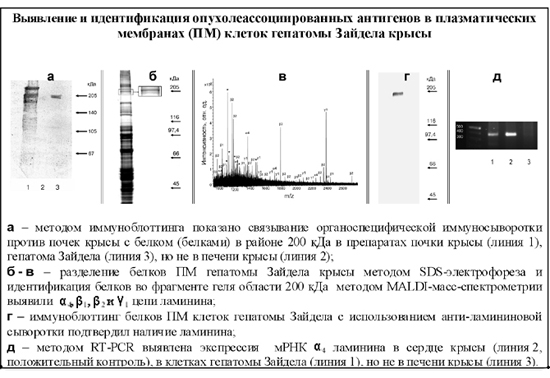
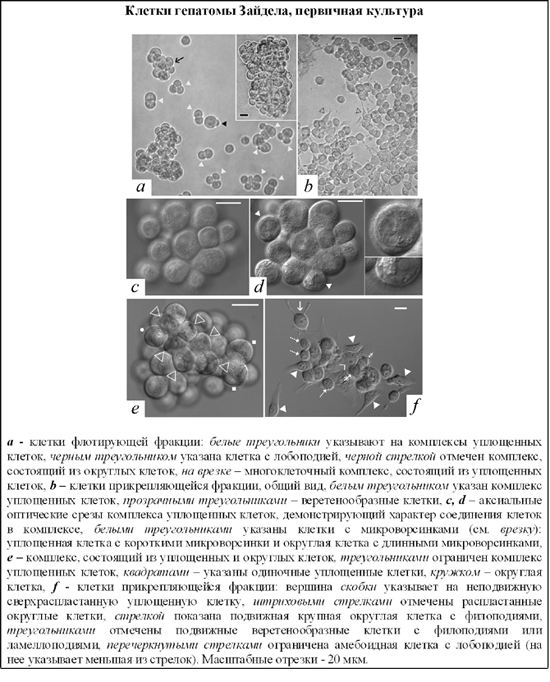
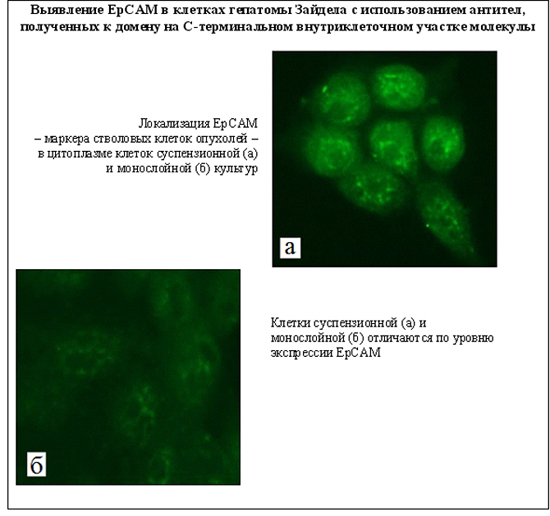
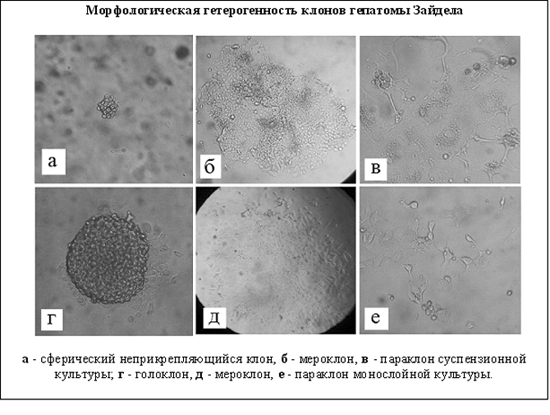
Важнейшие публикации: Ivanov V.A., Fel V.Ja. 1980. On some similarity between membrane antigens of the cell of Zajdela hepatoma and liver of rats subjected to a single 4-dimethylaminoazobenzene injection. Neoplasma. 27 (6): 745-750. Fel V.Ja., Zacharova N.V., Ivanov V.A., Medvedeva N.D., Khodosova I.A. 1982. Expression of a-fetoprotein, aldolase fetal isozyme A and heteroorganic antigens in rat liver cell after a single hepatocarcinogen treatment. Onco-developmental Biol. and Medicine. 1981. 2 (3): 197-201. "Цитологические аспекты первичного действия химических канцерогенов". (Коллективная монография). Л.: "Наука". 1982. 174с. Фель В.Я., Кушнер В.П., Иванов В.А., Трошин А.С. 1984. Ядерные негистоновые белки гепатом и печени крыс после действия гепатоканцерогенов и частичной гепатэктомии. ДАН СССР. 279 (4): 1008-1011. Филатова Н.А., Малыгин А.М., Плескач В.А., Фель В.Я. Естественная киллерная активность спленоцитов мышей линии С3НА в ранние сроки после трансплантации гепатомы 22а. Экспериментальная онкология 1987, т., №6, с.52-55. V.Ya.Fel'., A.M.Malygin. 1988. Problems of immune surveillance over the cytodifferentiation state and some cellular mechanisms of natural antitumor resistance. Int Rev Cytol. 110: 157-203. Филатова Н.А., Малыгин А.М.. Горюнова Л.Б., Фель В.Я., Хавинсон Б.Х. Иммуномодуляция естественной киллерной активности спленоцитов мышей С3НА в условиях роста гепатомы 22а. Цитология 1990, т.32, №6. с.652-658. Malygin AM, Redjko AA, Pogodina ON, Karaseva NA, Koval YF, Timonen T. 1993. Prognostic value of non-MHC-restricted killer cell activity in lung cancer. Cancer Immunol Immunother. 36 (1): 61-64. Плескач В.А., Кожухарова И.В., Арцибашева И.В., Тарунина М.В.. Филатова Н.А. Особенности культивирования, ростовые характеристики и онкогенность "бессывороточных" линий трансформированных фибробластов. Цитология 1994, т.36, №8, с.806-815. V.A. Ivanov, V.P. Kushner. 1994. Disdifferentiation of tumor cells and heteroorganic antigens. Proceedings of the XVI International Cancer Congress. P.536-537. В.А. Иванов, В.Я. Фель. 1995. Сравнительное изучение синтеза мембранных гетероорганных антигенов почечной природы на тканевых срезах и изолированных клетках после однократного канцерогенного воздействия на крыс. Цитология. 37 (3): 227-231. V.P.Kushner, G.I.Blinova, A.B.Grandilevskaya, A.A.Klimova, V.A.Ivanov. 1997. Stimulation of cell proliferation by chromosomal nonhistone proteins pp23. Experimental oncology. 19 (4): 300-306. О.Н.Погодина, Н.А.Карасева, В.А.Иванов. 1997. Изучение ответа лимфоцитов периферической крови больных раком легкого на обработку in vitro рекомбинантным интерлейкином-2. Цитология. 39 (7): 582-589. Константинова И.М., Илькаева О.Р., Филатова Н.А., Кожухарова И.В., Туроверова Л.В., Аточина О.В.. Плескач В.А. Экспорт и поглощение просомоподобных РНП ( alpha-РНП ) с иммуномодулирующей активностью в культуре клеток. ДАН 1999, т.365, с.700-703. Черныш С.И., Гордя Н.А., Филатова Н.А. Протекторные механизмы насекомых: темпы молекулярной и филогенетической эволюции. Исследования по генетике 1999, вып.12, с.52-59. N.K.Tokarevich, I.S.Freidlin, O.N.Pogodina, E.D.Prokopyeva, A.A.Prokopyev. 1999. Study of dynamics of the TNF production and the NK-activity in mice infected with Coxiella burnetii or ommunizated with inactivated whole cells of C. burnetii. In: Rickettsiae and rickettsial diseases at the turn of the thitd millennium. Eds. D.Raoult, P.Brouqui. Elsevier Paris. p.177-181. A.B. Grandilevskaya, I.G. Grusdeva, V.A. Ivanov. 2001. Comparative study of nonhistone chromosomal pp23 protein in normal and tumor rat cells. Experimental oncology. 23 (2): 104-108. S.I. Chernysh, S.I. Kim, G.P Becker, N.A. Filatova, V.A. Pleskach, V.B. Anikin, V.G. Platonov, Ph. Bulet. 2002. Antiviral and antitumor peptides from insects. PNAS. 99 (20): 12628-12632. С.А. Снопов, Ю.М. Розанов, С.М. Харит. 2002. Изменения численности CD4+CD8+ и CD4-CD8- лимфоцитов в периферической крови после вирусной иммунизации. Медицинская иммунология. 4 (2): 257-258. О.И.Зубанова, С.А. Снопов, В.М. Михельсон, К.А. Самойлова. 2002. Стимуляция репарации ДНК растворимыми факторами фотомодифицированной крови в клетках человека, поврежденных УФ- и ионизирующей радиацией. Цитология. 44 (5): 463-469. О.Н. Погодина, А.Г.Булычев. 2003. Влияние иммуносупрессоров циклофосфана и 5-фторурацила на естественную цитотоксичность и активность лизосомных ферментов спленоцитов мышей линии С3НА. Цитология. 45 (1): 74-80. О.Н. Погодина, А.Г.Булычев. 2004. Влияние процесса опухолевого роста на естественную цитотоксичность и активность некоторых лизосомных ферментов эффекторных клеток человека и спленоцитов мышей линии С3НА. Цитология. 46 (8): 675-684. S.I. Chernysh, N.A. Filatova, N.S. Chernysh, A. P. Nesin. 2004. Cytotoxic activity of the blowfly Calliphora vicina hemocytes. Journal of Insect Phisiology. 50: 777-781. S.A. Snopov, F. R. de Gruijl, L. Roza, J.C. van der Leun. 2004. Immunochemical study of DNA modifications in the nuclei of UV-damaged lymphocytes. Photochemical and Photobilogical Sciences. 3 (1): 85-90. И.И. Тюряева, О.А. Миргородская, О.А. Черепанова, Е.П. Подольская, А.В. Новиков, М.А. Ходорковский, В.А. Иванов. 2005. Выявление и идентификация ламинина в составе плазматических мембран клеток асцитной гепатомы Зайдела крысы. Цитология. 47 (2): 150-162. И.И. Тюряева, О.А. Миргородская, О.А. Черепанова, Е.П. Подольская, М.В. Серебрякова, В.А. Иванов. 2005. Взаимодействие ламинина с компонентами плазматических мембран клеток асцитной гепатомы Зайдела. Цитология. 47 (12): 1039-1047. Н.П.Терюкова, П.А. Ивашкина, О.А. Миргородская, В.А. Иванов. 2005. Выявление и идентификация опухолеассоциированного гетероорганного антигена гепатомы Зайдела в составе негистоновых белков хроматина. Цитология. 47 (12): 1048-1054. S.A. Snopov, S.M. Kharit, M. Norval, V.V. Ivanova. 2005. Circulating leukocyte and cytokine responses to measles and poliovirus vaccination in children after ultraviolet radiation exposures. The Archives of Virology. 150 (9): 1729-1743. С.А. Снопов, Л. Роза, Ф.Р. де Груйл. 2006. Замедленная эксцизия пиримидиновых димеров в нестимулированных лимфоцитах человека. Цитология. 48 (11): 958-965. Филатова Н.А., Кирпичникова К.М., Гамалей И.А. Уменьшение активности естественных киллеров по отношению к трансформированным фибробластам 3Т3SV40 обработанными N-ацетилцистеином. Цитология. 2006, т.48, №5, с.438-442. И.Г. Дуткевич, А.В. Марченко, С.А. Снопов. 2006. "Экстракорпоральная фотогемотерапия". СПб: Наука, 400 с. Н.П.Терюкова, А.С.Дешева, Г.И. Блинова, О.А Миргородская, В.А.Иванов. 2007. Сравнительное изучение антигенов, ассоциированных с плазматическими мембранами гепатомных и миогенных клеток крысы, с использованием антипочечной сыворотки. Цитология. 49 (11): 944-951. Филатова Н.А., Кирпичникова К.М.. Гамалей И.А. Реорганизация актинового цитоскелета в клетках 3Т3SV40 и чувствительность к литической активности естественных киллерных клеток. Цитология. 2008 т.50, №3 с. 261-267. И.И. Тюряева. 2008. Опухолевые антигены. Цитология. 50 (3): 189-209. N.A. Filatova, I.I. Tyuryaeva, V.A. Ivanov. 2008. Recognition and lysis by Natural killers of tumors cells with participation of laminin. Cell and Tissue Biology. 2 (1): 38- 44. N.P. Teryukova, G.I. Blinova, Yu.M. Rozanov, V.A. Ivanov. 2008. Study of surface heteroorganic antigens of rat hepatoma cells participating in the cell proliferation process. Cell and Tissue Biology. 2 (3): 246-252. N.A. Knyazev, K.A. Samoilova, N.A. Filatova, A.A. Galactionova. 2009. Effect of polychromatic visible light on proliferation of tumor cells under conditions in vitro and in vivo after implantation to experimental animals. American institute of physics (AIP) Conference Proceedings. Ed. L. Longo, Melville, New York, 1142: 79-86. S.V. Shabelnikov, O.A. Bystrova, V.A. Ivanov, B.A. Margulis, M. Martynova. 2009. Atrial granular cells of the snail Achatina fulica release proteins into hemolymph after stimulation of the heart nerve. J. Exp. Biol. 212: 3211-3220. Н.П.Терюкова, О.Н.Погодина, Г.И.Блинова, В.А.Иванов. 2009. Морфометрический анализ цитотоксического действия спленоцитов крыс и мышей на монослойные культуры клеток гепатом. Цитология. 51 (4): 302-310. Н.А. Филатова, К.М. Кирпичникова, Е.А. Вахромова И.А. Гамалей. 2009. Влияние альфа-липоевой кислоты на чувсвительность трансформированных фибробластов к литической активности естественных киллерных клеток. Сравнение с действием NAC. Цитология. 51 (5): 398-401. Н.П.Терюкова, О.А. Миргородская, М.В. Серебрякова, В.А.Иванов. 2010. Выявление и идентификация опухолеассоциированных антигенов в составе фракции, обогащенной плазматическими мембранами клеток асцитной гепатомы Зайдела. Цитология. 52(10):827-834. И.И. Тюряева, Н.А. Филатова, Ю.М. Розанов, С.Ю. Дёмин, В.А. Иванов. 2010. Морфологическая и функциональная гетерогенность клеток асцитной гепатомы Зайдела крысы. Цитология. 52 (10): 817-826. И.А. Гамалей, К.М. Кирпичникова, Е.А. Вахромова Н.А. Филатова. 2010. N-ацетилцистеин уменьшает чувствительность трансформированных и эмбриональных клеток к литическому действию естественных киллерных клеток. Цитология. 52 (7):555-561. Н.А. Филатова, В.И. Чубинский-Надеждин, В.А. Иванов, Е.А. Морачевская. 2010 Чувствительность к действию естественных киллеров зависит от целостности липидных рафтов в мембране трансформированных клеток. Цитология. 52 (12): 983-989. N. P. Teryukova, O. N. Pogodina, G. I. Blinova, and V. A. Ivanov. 2011. Immunomodulating Effect of Cyclophosphamide on Cytotoxic Activity of Rat and Mouse Splenocytes. Cell and Tissue Biology. 5 (6): 586-594. И.А. Гамалей, К.М. Кирпичникова, Н.А. Филатова. 2011. Влияние мелатонина на функциональные свойства трансформированных клеток. Вопросы онкологии. 54 (4): 481-485. Н.А. Филатова, К.М. Кирпичникова, Н.Д. Аксенов, Е.А. Вахромова, И.А. Гамалей. 2011. Уменьшение туморогенности клеток мышиной гепатомы после действия антиоксидантов и мелатонина. Цитология. 53 (5): 404-410. С.А. Снопов. 2012. Формирование иммунного ответа на вирусные и бактериальные антигены после курса ультрафиолетовых облучений в субэритемных дозах. Журнал инфектологии, 4(3): 137-142. С.А. Снопов, И.И. Тюряева. 2012. Вопросы политики и целей в системах управления качеством государственных научных учреждений. Сборник статей "Управление качеством в образовательных учреждениях и научных организациях". СПб.: "Легаси", С. 107-109. Н.А. Князев, Н.А. Филатова, К.А. Самойлова. 2012. Пролиферация и туморогенность клеток гепатомы мыши, облученных полихроматическим видимым и инфракрасным светом. Цитология. 54 (10): 774-782. О.М. Веселова, А.С. Голота, А.Б. Крассий, Е.В.Мурзина, А.С. Реуков, С.А. Снопов. 2013. Изучение биологического действия субмиллиметрового/терагерцевого излучения. Критический анализ методических аспектов. Глава 5 в кн. Высокотехнологичные методы лечения и реабилитации. Теория и практика. Ежегодник 2012. Под ред. С.Г. Щербака. Сестрорецк-СПб.: "Резюме". С. 90-105. N. P. Teryukova, G. I. Blinova, and V. A. Ivanov. 2013. Zajdela Hepatoma Cells Cultured in vitro. Cell and Tissue Biology, 2013. 7 (3) : 245-252. Н.П. Терюкова, О.Н.Погодина, Г.И. Блинова, В.А.Иванов. 2013. Цитотоксическая активность свежевыделенных спленоцитов мышей и крыс по отношению к опухолевым клеткам монослойных культур. Клеточные культуры. Информационный бюллетень. 29: 43-53. Н.А. Филатова, Н.А. Князев, В.В. Кошеверова, А.Н. Шатрова, К.А. Самойлова. 2013. Влияние облучения полихроматическим видимым и инфракрасным светом на туморогенность клеток мышиной гепатомы 22а и их чувствительность к лизису естественными киллерами. Цитология. 55 (7): 501-506.
|