| Лаборатория динамики внутриклеточных мембран |
КОРНИЛОВА Елена Сергеевнад.б.н., профессорТел.: +7 (812) 297-4596
Лаборатория была создана в 2005 г на базе Группы везикулярного транспорта Лаборатории физиологии клеточного цикла и Группы биохимии лизосомно-вакуолярного аппарата Лаборатории биохимической цитологии и цитохимии. Состав: 8 научных сотрудников (из них 2 доктора наук, 4 кандидата наук). |

|

|
Основным направлением работы лаборатории является исследование эндоцитоза рецепторов ЭФР - процесса, запускаемого одновременно с формированием
ЭФР-рецепторных комплексов на плазматической мембране. Работа развивается по трем направлениям: (1) анализ роли убиквитинирования рецептора в регуляции
его лизосомной деградации; (2) роль тубулинового цитоскелета в координации процессов эндоцитоза и сигналинга рецептора ЭФР; (3) изменения регуляции
эндоцитоза в процессе дифференцировки клеток. Кроме того, в Лаборатории проводятся исследования возможности применения новых полупроводниковых
флуоресцентных нанокристаллов ("квантовых точек") для решения фундаментальных и прикладных задач клеточной биологии.
Работы лаборатории поддерживаются грантами РФФИ, Правительства Санкт-Петербурга и грантами для молодых ученых, грантами Программ Президиума РАН "Молекулярная и клеточная биология" и "Основы фундаментальных исследований нанотехнологий и наноматериалов", грантом Президента РФ для поддержки Ведущих научных школ. Сотрудники имеют опыт работы в лабораториях Великобритании, Швейцарии, США, Германии, Бельгии, Канады и Финляндии. Многие пептидные гормоны и ростовые факторы вызывают разнообразные клеточные ответы, действуя через свои высокоспецифичные трансмембранные рецепторы. Как правило, эти рецепторы либо сопряжены с внутриклеточными тирозикиназами, либо их цитоплазматический домен сам обладает тирозинкиназой активностью. К последней группе принадлежит один из наиболее широко экспрессируемых рецепторов - рецептор эпидермального фактора роста (ЭФР), регулирующий целый спектр клеточных процессов - от пролиферации до дифференцировки, клеточной подвижности и выживании при апоптозе. Вскоре после идентификации рецептора ЭФР (конец 1970х годов) выяснилось, что ЭФР-рецепторные комплексы подвергаются эндоцитозу, заканчивающемуся деградацией и лиганда, и рецептора в лизосомах. Этот факт наводил на мысль о том, что основное назначение эндоцитоза - прекращение сигнала, стимулированного на плазматической мембране. Однако последнее десятилетие принесло массу доказательств того, что интернализованный рецептор в эндосомах может стимулировать новые сигналы, а в организации эндоцитозного пути участвует столь большое количество различных белков, белковых комплексов и липидов, что задача деградации рецептора явно не является единственной, а возможно, и основной. Очевидно, что вопрос о роли эндоцитоза сигнальных рецепторов остается в значительной мере открытым. Работа Лаборатории в настоящее время фактически является продолжением исследований, проводимых нашими сотрудниками в течение многих лет. За это время нами было показано, что интернализованный рецептор может не только направляться на деградацию в лизосомы, но и рециклировать, причем соотношение между этими путями может изменяться в широких пределах в клетках одной и той же линии. Мы продемонстрировали, что С-терминальный регуляторный домен рецептора, содержащий основные сайты фосфорилирования по тирозину, способен модулировать эффективность сортировки рецептора на путь деградации. Изучая роль малых ГТФаз Rab5 и Rab7, а также фосфатилилинозитолмонофосфата, мы пришли к заключению, что биогенез эндосом происходит по механизму созревания. Анализируя роль убиквитин-лигазы c-Cb1, мы обнаружили, что статус убиквитинирования рецептора определяется балансом активностей с-Cb1 и деубиквитинирующих ферментов на всем протяжении эндоцитозного пути. Динамика изменения паттерна убиквитинирования рецепора позволяет предполагать, что именно убиквитинирование может координировать процесс последовательного взаимодействия рецептора с сортирующими ESCRT-комплексами. Эти и другие данные позволяют рассматривать эндоцитоз ЭФР-рецепторных комплексов как чрезвычайно лабильный процесс, находящийся под контролем не только ЭФР, но и всего сигнального контекста, в котором находится клетка. С учетом данных о множественных взаимодействиях эндоцитозных белков-регуляторов и сигнальных белков, очевидно, что такая лабильность повышает возможности клетки к адаптации и влияет на окончательный клеточный ответ, генерируемый одним и тем же фактором - ЭФР. Таким образом, эндоцитоз можно рассматривать как процесс, позволяющий интегрировать различные сигнальные пути "во времени и пространстве" внутри клетки. Основным направлением исследований в настоящее время является изучение взаимосвязи эндоцитоза ЭФР-рецепторных комплексов с другой интегральной системой клетки - тубулиновым цитоскелетом. Вопреки представлениям о микротрубочках в интерфазных клетках как о стабильной системе рельсов, по которым с помощью моторного белка эндосомы перемещаются в околоядерную область, мы обнаружили, что микротрубочки после стимуляции эндоцитоза ЭФР претерпевают существенное ремоделирование, связанное с изменением их свойств. В задачу работы входит выяснение механизмов ремоделирования, выявления стадий, регулируемых как самим рецептором, так и другими сигналами, в том числе ЭФР-независимыми, участие в этих процессах белков-регуляторов везикулярного транспорта, а также белков, способных стабилизировать или дестабилизировать микротрубочки. Выясняется роль посттрансляционных модификаций МТ, возможное влияние внутриэндосомального закисления, локального редокс-статуса и изменения локальной концентрации ионов кальция в регуляции процесса созревания рецептор-содержащих эндосом. 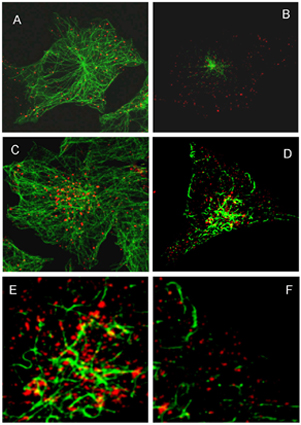
Рис.1. Укрупнение эндосом на поздних стадиях эндоцитоза происходит на высокоацетилированных микротрубочках (МТ)
Клетки, фиксированные через 15 (А,В) и 60 (C –D ) мин после стимуляции эндоцитоза, окрашивали первичными антителами против альфа-тубулина и рецептора ЭФР (А,С) и ацетилированного тубулина и рецептора ЭФР (В, D – F), с последующей окраской соответствующими вторичными антителами. E и F – увеличенные изображения центра и периферии клетки, представленной на имидже D. Изображения получены на конфокальном микроскопе LEICA TCS SL. Второе направление работы связано с изучением изменения свойств мембран и характера эндоцитоза в процессе дифференцировки. В качестве модели
используется стимулируемая дифференцировка культивируемых миобластов в миотубулы.
Третье направление работ Лаборатории связано с исследованием возможности применения нового флуорофора с уникальными оптическим свойствами - полупроводниковых флуоресцентных нанокристаллов (2-9 нм), так называемых квантовых точек (КТ), как долгоживущего маркера изучаемых белков, дающего возможность отслеживать поведение единичных молекул. Высокий квантовый выход КТ, их фотостабильность , зависимость длины волны испускания от размеров, больший сдвиг Стокса и другие свойства делают их чрезвычайно привлекательными для использования в практических целях диагностики и терапии. Однако токсичность материалов, из которых состоят КТ, существенное увеличение размеров после функционализации, позволяющей придавать им специфичность, и ряд других проблем ставят под вопрос возможности их немедленного применения. Задачей нашей работы в этом направлении является выяснение того, как разные способы функционализации и введения в клетку могут повлиять на судьбу меченых квантовыми точками молекул внутри клетки, каковы пути их выхода из клеток и дальнейшей судьбы на уровне организма в целом. Наиболее существенными эти моменты являются в случае мечения белков, имеющих сигнальные функции, например, ЭФР. Основной вопрос, на который мы пытаемся ответить, заключается в том, какие изменения в функционирование сигнальных путей могут вносить КД. Эти моменты весьма существенны для разработки адекватных подходов использования КТ в диагностических и терапевтических целях. 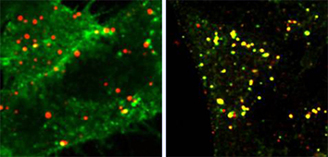
Рис. 2. Квантовые точки, конъюгированные с ЭФР, поступают в клетки HeLa с помощью эндоцитоза, опосредованного рецептором ЭФР
Салова А. В., Леонтьева Е. А., Моженок Т. П., Корнилова Е. С., Кроленко С. А., Беляева Т. Н. 2011. Изменение локализации компонентов везикулярного аппарата клетки в процессе дифференцировки миобластов в миотубулы в культуре. Цитология (в печати) Злобина М. В., Харченко М. В., Латкин Д. С., Корнилова Е. С. 2010. Ацетилирование микротрубочек в ходе эндоцитоза рецептора эпидермального фактора роста (c-ErbВ1) в интерфазных клетках линии HeLa. Цитология. 52 (6) : 466-476 Kirill A. Kondratov, Alexander L. Chernorudskiy, Alina P. Amosova and Elena S. Kornilova. 2010.Termination of tyrphostin AG1478 application results in different recovery of EGF receptor tyrosine residues 1045 and 1173 phosphorylation in A431 cells. Cell Biol Int., 34 (1):81-87 Беляева Т. Н., Салова А. В., Леонтьева Е. А., Моженок Т. М., Корнилова Е. С., Кроленко С. А. Нецелевые квантовые точки в прижизненных конфокально-микроскопических исследованиях клеток. Цитология. 2009. Т. 51 (10). С. 830-837 Кондратов К. А., Меликова М. С, Чернорудский А. Л., Корнилова Е. С. 2009. Убиквитинирование рецепторов ЭФР с делециями и точечными мутациями С-терминального домена в ходе эндоцитоза. Цитология. 51 (7): 617-623 Кондратов К. А., Чернорудский А. Л., Амосова А. П., Корнилова Е. С. 2009. Анализ влияния тирфостина AG1478 на поведение интернализованного рецептора ЭФР на разных стадиях эндоцитоза. Цитология. 51 (6): 520-525 Беляева Т. Н., С. А. Кроленко, Е. А. Леонтьева,Т. П. Моженок, А. В. Салова, М. Д.Фаддеева. Распределение и спектры флуоресценции АО в миобластах и одиночных мышечных волокнах. Цитология. 2009. 51 (2):103-110 Kharchenko M. V., Aksyonov A. A., Melikova M. M., E.S. Kornilova . Epidermal growth factor (EGF) receptor endocytosis is accompanied by reorganization of microtubule system in HeLa cells. Cell Biol. Int. 2007. 31 : 349-359. С.А. Кроленко, С.Я. Адамян, Т.Н. Беляева, Т.П. Моженок, А.В. Салова. Конфокально-микроскопическое исследование мембранных органоидов скелетного мышечного волокна в процессе распространяющегося некроза. Цитология. 2007. 49 (2): 107-114. Melikova Maria S, Kondratov Kirill A, Kornilova Elena S. 2006. Two different stages of epidermal growth factor (EGF) receptor endocytosis are sensitive to free ubiquitin depletion produced by proteasome inhibitor MG132. Cell Biology International 30: 31-43. Железнова Н.Н., Меликова М.С., Харченко М.В., Никольский Н.Н., Корнилова Е.С. 2003. Участие ФИ-3-киназ I и III-его типов в регуляции эндоцитоза рецепторов ЭФР. Цитология. 45 (6) : 574 - 581. T. Belyaeva, E. Leontieva, A. Shpakov, T. Mozhenok, M. Faddejeva. 2003. Sensitivity of lysosomal enzymes to the plant alkaloid sanguinarine: comparison with other SH-specific agents. Cell Biol. Int. V. 27: 887-895 С.А. Кроленко, С.Я. Адамян, Т.Н. Беляева, Т.П. Моженок. 2003. Локализация кислых органоидов в скелетных мышечных волокнах. Цитология. . 45 (7): 714-721. Меликова М.С., Филатова М.М., Корнилова Е.С. 2003. с-Сb1 - полифункциональный регулятор клеточных процессов. Цитология. 45 (11) : 1134-1148. Обзор Харченко М.В., Аксенов Н.Д., Корнилова Е.С. 2002. Влияние гипертонического раствора сахарозы и N-(N-гексаметилен)-амилорида на рецептор-опосредованный и жидкофазный эндоцитоз. Цитология. 44(7):681-90 Т.П. Моженок, Е.А. Леонтьева, Т.Н. Беляева. 2002. Влияние катионных векторов трансфекции в комплексе с плазмидной ДНК на слияние лизосом с фагосомами в перитонеальных макрофагах мыши и в макрофагах линии J774. Цитология. 44(9): 825-829. Меликова М.С., Благовещенская А.Д., Никольский Н.Н., Корнилова Е.С. 2002. Влияние ингибитора вакуолярной протонной помпы Бафиломицина А1 на внутриклеточный процессинг маркеров рецептор-опосредованного и жидкофазного эндоцитоза. Цитология. 44 (8): 807-816. Железнова Н.Н., Меликова М.С., Никольский Н.Н, Корнилова Е.С. 2001. Исследование роли Src-киназы в регуляции эндоцитоза ЭФР-рецепторных комплексов. I. Анализ динамики интернализации, рециклирования, сортировки и деградации ЭФР в условиях подавления активности Src-киназы. Цитология. 43: 1136-1145. Krolenko S.A., Lucy J.A. 2001. Reversible vacuolation of T-tubules in skeletal muscle: mechanisms and implications for cell biology. Int. Rev. Cytol. V. 202: 243-298. Железнова Н.Н., Никольский Н.Н. Корнилова Е.С. 2001. Влияние вортманнина на эндоцитоз ЭФР-рецепторных комплексов в клетках А431. Цитология, 43: 156-165. Melikova M.S., Blagoveshchenskaya A.D., Nikolsky N.N., Kornilova E.S. 2001. Influence of vacuolar proton pump inhibitor Bafilomycin A1 on intracellular processing of receptor-mediated and fluid phase endocytosis markers. Mol. Biol. Cell. 12 344a-345a. Т.П. Моженок, Т.Н. Беляева, А.Г. Булычев, Е.А. Леонтьева. 2000. Влияние ингибиторов синтеза полиаминов раздельно и в сочетании с эпидермальным фактором роста на слияние лизосом с фагосомами и на содержание Ф-актина в перитонеальных макрофагах мыши. Цитология. Т.42 (6): 573-577. Авров К.О., Аксенов Н.Д., Меликова М.С., Никольский Н.Н., Корнилова Е.С. 1999. Исследование эндоцитоза ЭФР-рецепторных комплексов на разных стадиях клеточного цикла. Цитология, 42 (12) :1007-10013. Соколова И.П., Арнаутов А.М., Благовещенская А.Д., Никольский Н.Н., Корнилова Е.С. (1998) Влияние нокодазола на эндоцитоз рецептора эпидермального фактора роста. Цитология,40 (10): 855-861 Соколова И.П., Арнаутов А.М., Никольский Н.Н., Корнилова Е.С. 1998. Исследование ассоциации малой ГТФазы Rab7 с эндосомами клеток, экспрессирующих нормальную и мутантные формы рецептора ЭФР. Цитология, 40 (10) : 862-868. T. Mozhenok, T. Belyaeva, A .Bulychev, I .Kuznetsova, E .Leontieva, M.Faddejeva. 1998. Effects of some biologically active compounds on phagosome-lysosome fusion in peritoneal macrophages of mice. Cell Biol. Int.22: 465-472. Gilbert A., Jadot M., Leontieva E., Wattiaux-De Coninc S., Wattiaux R. 1998. DeltaF508 CFTR localizes in the endoplasmic reticulum-Golgi intermediate compartment in cystic fibrosis cells. Exp.Cell Res. 242. : 144-152. S.A. Krolenko, W.B. Amos, S.C. Brown, M.V. Tarunina, J.A. Lucy. 1998. Accessibility of T-tubule vacuoles to extracellular dextran and DNA: mechanism and potential application of vacuolation. J. Muscle Res. and Cell Motil. 19: 603-611. Kornilova E., Sorkina T., Beguinot L., Sorkin A. 1996. Carboxyl-terminal receptor domain 1022-1123 is responsible for the lysosomal targeting of EGF receptors. J.B.C., 271: 30340-30346. Булычев А. Г., Моженок Т. П. 1996. Вакуолярный аппарат и слияние мембран в клетке. Цитология. 38 (10): 1001-1035.Обзор Кроленко С.. А.., Адамян С. Я. 1996. Влияние ингибиторов мембранного транспорта на вакуолизацию скелетных мышечных волокон, вызванную выходом из них глицерина. Цитология. 38 (7): 751-757. Krolenko S.A., Amos W.B., Lucy J.A. 1995. Reversible vacuolation of the transverse tubules of frog skeletal muscle: a confocal fluorescence microscopy study. J. Muscle Res. Cell Motil. V.16: 401-411. Соколова И.П., Вдовина И.Б., Корнилова Е.С., Никольский Н.Н. 1995. Компартментализация эпидермального фактора роста (ЭФР) в ходе эндоцитоза в клетках, экспрессирующих нормальный и лишенный основных сайтов автофосфорилирования рецептор ЭФР. Цитология, 37: 873-882. Wels W., Beerli R., Hellman P., Schidt M., Marte B.M., Kornilova E.S., Hekele A., Mendelsohn J., Groner B., Hynes E. 1995. EGF receptor and p185erb-2-specific single-chain antibody toxins differ in their cell-killing activity on tumor cells expressing both receptor proteins. Int. J. Cancer. 60: 137-144.. Kornilova E.S., D. Taverna, W. Hoeck and N.E.Hynes. 1992. Surface expression of erb B-2 protein is post-transcriptionally regulated in mammary epithelial cells by epidermal growth factor and by culture density. Oncogene, 7: 511-519. Sorkin A., E.Kornilova, S. Krolenko. 1992. Two recycling pathways of epidermal growth factor receptor complexes in A431 cells. NATO ASI Series, Vol H62: (180-186) Endocytosis. Ed. by P. J. Courtoy, Springer - Verlag, Berlin- Heidelberg. Sorkin A., Kornilova E., Teslenko L., Sorokin A., Nikolsky N. 1988. Recycling of epidermal growth factor-receptor complexes in A431 cells. BBA, 1011: 88-96. |